KEMOLALAN DAN FRAKSI MOL
Kemolalan (m)
Kemolalan atau molalitas
menyatakan jumlah mol (n) zat terlarut dalam 1 kg ( = 1.000 g) pelarut.
Oleh karena itu, kemolalan dinyatakan dalam mol kg-1.
m = n/p
m = kemolalan larutan
n = jumlah mol zat terlarut
p = massa pelarut (dalam kg)
Contoh :
Berapakah kemolalan larutan yang dibuat dengan mencampurkan 3 gram urea dengan 200 gram air ?
Jawab : larutan 3 gram urea dalam 200 gram air.
Mol urea = 3 /60 g mol-1 = 0,05 mol
Massa pelarut = 200 gram = 0,2 kg
m = n/p = 0,05 mol = 0,25 mol kg-1
0,2 kg
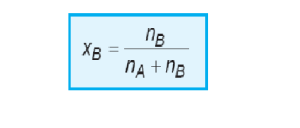
Fraksi mol (X)
Fraksi mol (x) menyatakan
perbandingan jumlah mol zat terlarut atau pelarut terhadap jumlah mol
larutan. Jika jumlah mol zat pelarut adalah nA, dan jumlah mol zat
terlarut adalah nB, maka fraksi mol pelarut dan zat terlarut adalah :
Jumlah fraksi mol pelarut dengan zat terlarut adalah 1
XA + XB = 1
Contoh :
Hitunglah fraksi mol urea dalam larutan urea 20% (Mr urea = 60 )
Jawab :
Dalam 100 gram larutan urea 20% terdapat 20 gram dan 80 gram air.
Mol air = 80 g/ 18 g mol-1 = 4,44 mol
Mol urea = 20 g/ 60 g mol-1 = 0,33 mol
X urea = XB = 0,33 mol / (4,44 + 0,33) mol = 0,069
SIFAT KOLIGATIF LARUTAN, TEKANAN UAP
JENUH LARUTAN DAN TITIK DIDIH LARUTAN ELEKTROLIT
DAN NON ELEKTROLIT
Sifat koligatif
Sifat koligatif adalah sifat-sifat fisik larutan yang hanya bergantung pada konsentrasi partikel
zat terlarut, tetapi tidak pada jenisnya. Larutan elektrolit mempunyai
sifat koligatif yang lebih besar dari pada larutan non elektrolit
berkonsentrasi sama karena larutan elektrolit mempunyai jumlah partikel
terlarut yang lebih banyak.
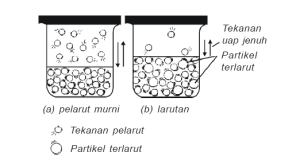
Tekanan Uap Larutan
Tekanan uap suatu zat adalah
tekanan yang ditimbulkan oleh uap jenuh zat itu. Semakin tinggi suhu,
semakin besar tekanan uap. Jika zat terlarut tidak menguap maka tekanan
uap larutan menjadi lebih rendah dari tekanan uap pelarutnya. Selisih
antara uap pelarut murni (P0) dengan tekanan uap larutan (P) disebut penurunan tekanan uap larutan (ΔP).
ΔP = P0 – P
Menurut Roulth, jika zat terlarut
tidak menguap, maka penurunan tekanan uap larutan sebanding dengan
fraksi mol terlarut, sedangkan tekanan uap larutan sebanding dengan
fraksi mol pelarut.
P = Xpel x P0
ΔP = Xter x P0
Zat terlarut menurunkan tekanan uap pelarut.
Contoh :
Tekanan uap air pada 1000C adalah 760 mmHg. Berapakah tekanan uap larutan glukosa 18% pada 1000C ( Ar H = 1, C = 12, O = 16 )
Jawab :
Dalam 100 gram larutan glukosa 18% terdapat :
Glukosa 18% = 18/100 x 100 gram = 18 g
Air = 100 – 18 g = 82 gram
Jumlah mol glukosa = 18 g/ 180 g mol-1 = 0,1 mol
Jumlah mol air = 82 g/ 18 gmol-1 = 4,55 mol
Xpel = 4,55/(4,55 + 0,1)
P = Xpel x P0 = ( 4,55 x 760 mmHg) /(4,55 + 0,1)
= 743,66 mmHg
Kenaikkan Titik Didih
Larutan mempunyai titik didih
lebih tinggi dan titik beku lebih rendah dari pada pelarutnya. Selisih
antara titik didih larutan dengan titik didih pelarut disebut kenaikkan
titik didih (ΔTb). Rumus : ΔTb = Kb x m
Dimana : m = molalitas larutan
Kb = tetapan kenaikkan titik didih
Contoh :
Tentukan titik didih larutan yang mengandung 18 g glukosa (Mr = 180) dalam 500 g air. Kb air = 0,520C/m.
Jawab :
Jumlah mol glukosa = 18 g/ 180 g mol-1 = 0,1 mol
Kemolalan larutan = 0,1 mol / 0,5 kg = 0,2 mol kg-1
Titik didih , ΔTb = Kb x m = 0,2 x 0,520C = 0,1040C
TITIK BEKU, DIAGRAM PT DAN TEKANAN
OSMOSIS LARUTAN ELEKTROLIT DAN NON ELEKTROLIT
Penurunan Titik Beku
Kenaikkan titik didih dan
penurunan titik beku sebanding dengan kemolalan larutan : ΔTb = m x
Kb dan ΔTf = m x Kf . Selisih antara titik beku pelarut
dengan titik beku larutan disebut penurunan titik beku (ΔTf).
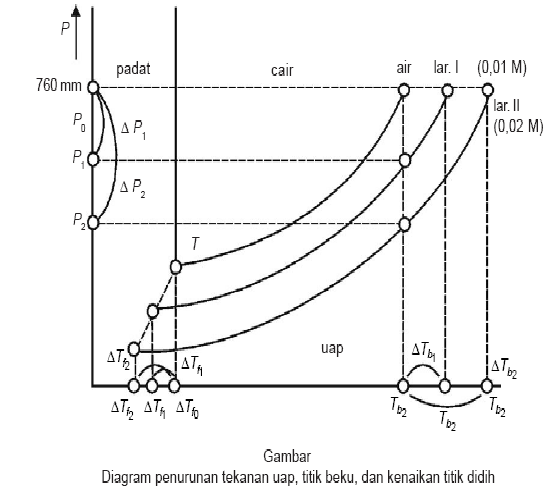
Kenaikkan titik didih dan penurunan titik beku larutan dapat
dijelaskan dengan diagram fase.
Contoh soal :
Tentukan titik beku larutan yang mengandung 18 g glukosa (Mr = 180) dalam 500 g air. Kf air = 1,860C/m.
Jawab :
Jumlah mol glukosa = 18 g/ 180 g mol-1 = 0,1 mol
Kemolalan larutan = 0,1 mol / 0,5 kg = 0,2 mol kg-1
Titik didih , ΔTf = Kb x m = 0,2 x 1,860C = 0,3720C
Diagram Fase (PT)
- Menyatakan batas – batas suhu dan tekanan di mana suatu fase dapat stabil.
- Suatu cairan mendidih pada saat tekanan uap jenuhnya sama dengan tekanan permukaan
- Oleh karena larutan mempunyai tekanan uap lebih rendah, maka larutan mempunyai titik didih lebih tibggi daripada pelarutnya.
Tekanan Osmotik
- Osmosis adalah perembesan molekul pelarut dari pelarut kedalam larutan, atau dari larutan lebih encer ke larutan lebih pekat, melalui selaput semipermiable.
- Tekanan
osmotic adalah tekanan yang harus diberikan pada permukaan larutan
untuk mencegah terjadinya osmosis dari pelarut murni.
- Rumus : л = M . R .T
- Larutan – larutan yang mempunyai tekanan osmotic sama disebut isotonic
Contoh soal ;
Berapakah tekanan osmotic larutan sukrosa 0,0010 M pada 250C ?
Jawab : л = M . R .T
= 0,0010 mol L-1 x 0,08205 L atm mol-1K-1 x 298 K
= 0,024 atm ( = 18 mmHg)

Tidak ada komentar:
Posting Komentar